3 - Stabilité et spectre d'émission des atomes
L'observation
Dans le même ordre d’idée, les scientifiques de l’époque avaient élaboré un modèle de l’atome qui permettait d’expliquer un grand nombre d’expériences en physique et en chimie. Il se basait sur l’existence de l’électron (découvert par Joseph John Thomson en 1897) qui était supposé " graviter " (c’est un abus de langage car ceci n’a rien à voir avec la gravitation!) autour d’un noyau de charge positive. Ce modèle planétaire est a priori viable puisque rien n’empêche un électron de tourner sur une orbite circulaire stable avec un bilan des forces nulles (force d’attraction du noyau = force centrifuge). Néanmoins, on savait également à l’époque qu’une particule chargée qui subit une accélération émet un rayonnement et donc perd de l’énergie. Dans le modèle planétaire de l’atome, l’électron subit une accélération centripète et par suite devrait émettre un rayonnement et ainsi perdre de l’énergie, pour finalement venir s’écraser sur le noyau !
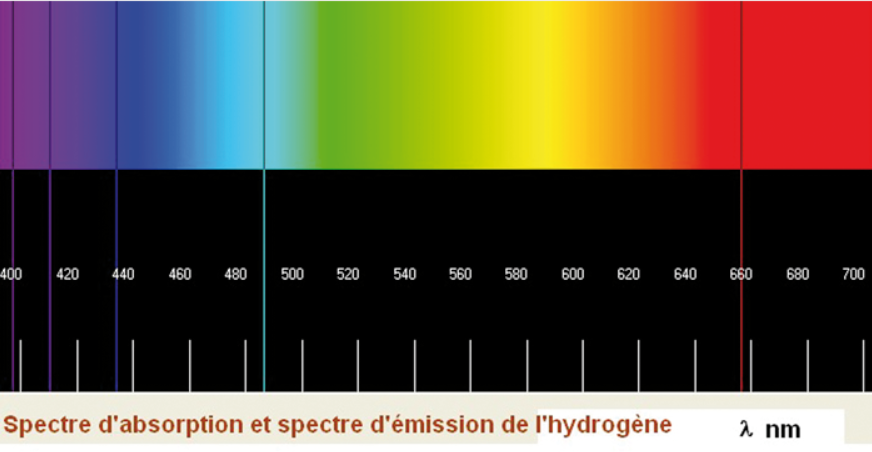
De même dans ce modèle, on ne prévoit pas une seule orbite mais un grand nombre de solutions. Cet aspect discret des orbites permet ainsi d'expliquer qualitativement les spectres d'émission des atomes, en supposant que lorsque l'électron passe d'une orbite à une autre il émette un rayonnement. Ces spectres représentent la longueur d'onde du rayonnement détecté pour un élément donné. L'exemple du spectre de l'hydrogène est donné sur la figure 3. Malheureusement, il est impossible de justifier les valeurs obtenues avec l'approche classique. Il y a donc pas mal de choses qui clochent...
Spectre d'émission des atomes : le modèle de Bohr
Pour expliquer le spectre d’émission de l’atome d’hydrogène, Niels Bohr proposa en 1913 un modèle de l’atome basé sur le modèle planétaire, mais en s’inspirant des résultats sur les quanta d’énergie. Il considère en effet que les électrons " tournent " autour du noyau mais pas avec n’importe quelle orbite, ou plus précisément pas avec n’importe quel moment cinétique. Il proposait donc de quantifier le moment cinétique comme étant un multiple de la fameuse constante de Planck. Il aboutit alors à une quantification des niveaux d’énergie. Ensuite, il postule que lorsqu’un électron passe d’un niveau de haute énergie vers un niveau de plus basse énergie, il émet un photon. A l’inverse, il propose qu’un électron passe vers un niveau excité par absorption d’un photon ayant une énergie suffisante. En résumé, il émet 3 postulats qu’il suppose valables pour tout système à l’échelle atomique (figure 4):
(i) Quantification de l’énergie : un système à l’échelle atomique ne peut exister que dans certains états stationnaires. L’énergie d’un tel système ne peut donc prendre que des valeurs discrètes, qui définissent les niveaux d’énergie
(ii) Emission d’un photon : quand le système passe d’un état stationnaire de haute énergie
![]() vers un état stationnaire de plus basse énergie
vers un état stationnaire de plus basse énergie
![]() , il émet un photon de fréquence fixée égale à
, il émet un photon de fréquence fixée égale à
![]()
(iii) Absorption d’un photon: à l’inverse, le système dans un état stationnaire peut accéder à un autre état stationnaire par absorption d’un photon d’énergie correspondant à l’écart d’énergie entre les deux états.
Voir l'animation : Hypothèses de Bohr
Partons de la première hypothèse et écrivons ainsi la relation fondamentale de la dynamique pour un électron supposé avoir une orbite circulaire de rayon
![]() autour du noyau :
autour du noyau :
![]()
ainsi que la condition de quantification du moment cinétique :
![]()
Remarquer la notation
![]() prononcée " h barre " adoptée car souvent rencontrée sous cette forme. Ces équations donnent pour la plus petite orbite (n=1) le rayon dit rayon de Bohr très souvent notée
prononcée " h barre " adoptée car souvent rencontrée sous cette forme. Ces équations donnent pour la plus petite orbite (n=1) le rayon dit rayon de Bohr très souvent notée
![]() :
:
![]()
L’ordre de grandeur trouvé correspond bien à la taille observée des atomes. Enfin, les niveaux électroniques dans ce modèle se calculent simplement par exemple comme :
![]()
Compte tenu des relations précédentes, on obtient ainsi l’énergie suivante :
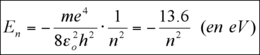
Cette formule s’est même encore avérée valable pour des atomes hydrogénoïdes, c’est à dire ne possédant qu’un électron sur la couche externe, l’énergie s’écrivant alors :
![]()
Une telle structuration des " couches " électroniques a permis d’expliquer quantitativement le spectre de raies de l’atome d’hydrogène : ainsi lorsque les électrons sont excités d’une couche à une autre, lorsqu’ils redescendent vers un état plus stable ils libèrent de l’énergie sous forme de photons, à des fréquences bien précises. Vous vérifierez en exercice qu’une telle expression explique très bien quantitativement le spectre d’émission de la figure 3, ce qui fit le succès spectaculaire du modèle de Bohr. Malheureusement, les choses se compliquèrent pour des spectres d’absorption plus complexes, montrant les limites du modèle de Bohr. Mais on était sur la bonne voie.
Pour finir, posez vous la question suivante : pourquoi avec le modèle classique était-il impossible de coller à l'expérience ?
réponse : il manquait une constante universelle, à savoir la constante de Planck h!
